ONKOGENE MET-ALTERATIONEN BEIM NICHT-KLEINZELLIGEN LUNGENKREBS
6. THERAPIEOPTIONEN BEI MET-ALTERIERTEM NSCLC
6.1 IMMUNTHERAPIEN
Wie einige Studien zeigen konnten, ist der Anteil an MET-dysregulierten Patient*innen mit einem PD-L1-Tumor-Proportion-Score (TPS) > 50 % im Vergleich zu Patient*innen mit anderen molekularen Treibern oder Wildtyp-NSCLC hoch [Hong et al. 2021]. Beispielsweise hatten in einer bizentrischen US-amerikanischen sowie einer bizentrischen asiatischen Studie von 147 bzw. 13 Patient*innen mit METex14-mutiertem NSCLC 41 % bzw. 69 % einen PD-L1-TPS ≥ 50 % [Sabari et al. 2018, Xu et al. 2020]. In einer deutschen Studie des nationalen Netzwerks Genomische Medizin (nNGM) wiesen 34,8 % der 227 Patient*innen mit MET-Amp oder METex14-Mutation einen PD-L1-TPS ≥ 50 % auf [Kron et al. 2021]. Dennoch liegen bisher nur wenige Daten zur Wirksamkeit von Immuntherapien bei NSCLC-Patient*innen mit MET-Dysregulation vor. In der Studie von Sabari et al. wurde beispielsweise unter 24 Patient*innen mit METex14-Mutation, die eine Immuntherapie erhalten hatten, eine Gesamtansprechrate (ORR) von 17 % und ein medianes progressionsfreies Überleben (mPFS) von 1,9 Monaten beobachtet. Dabei zeigte sich keine Korrelation zwischen dem Ansprechen und der PD-L1-Expression [Sabari et al. 2018]. In zwei weiteren retrospektiven Studien, welche die Wirksamkeit von Immuntherapien bei NSCLC mit verschiedenen molekularen Treibern untersuchten, ergab sich zum einen für 36 eingeschlossene Patient*innen mit METex14- Mutation oder MET-Amp eine ORR von 16 % sowie ein mPFS von 3,4 Monaten und zum anderen für 30 Patient*innen mit METex14-Mutation eine ORR von 35,7 % und ein mPFS von 4,9 Monaten [Guisier et al. 2020, Mazieres et al. 2019]. Im Vergleich dazu betrug beispielsweise die ORR bei MET-unselektierten Patient*innen mit einem PD-L1-TPS ≥ 50 % unter Pembrolizumab 46 % und unter Atezolizumab 38 %. Die jeweiligen Ergebnisse für das mPFS waren 7,7 und 8,1 Monate [Herbst et al. 2020, Reck et al. 2021]. Diese Ergebnisse deuten insgesamt auf eine schlechtere Wirksamkeit von Immun-Monotherapien bei NSCLC mit MET-Dysregulation hin. Wie bereits für andere molekulare Treiber gezeigt, sind zielgerichtete Therapien mit TKI bei vorliegender MET-Dysregulation mit einer besseren Wirksamkeit verbunden [Awad et al. 2019]. Generell soll Patient*innen mit positivem Mutationsstatus und bei verfügbarer zielgerichteter Therapie ein TKI als Erstlinientherapie und, falls vorhanden, alternative TKI in weiteren Therapielinien angeboten werden [Leitlinienprogramm Onkologie 2018].
6.2 TKI MIT (BEANTRAGTER) ZULASSUNG
Capmatinib ist ein Typ-I-Inhibitor des MET-Rezeptors, d. h. der TKI blockiert die ATP-Bindungstasche von MET im aktiven Zustand. Außerhalb der EU ist der Wirkstoff in mehreren Ländern, z. B. in den USA und der Schweiz, zur Therapie des METex14-mutierten NSCLC bei erwachsenen Patient*innen zugelassen, die EU-Zulassung ist aktuell bei der EMA beantragt. Capmatinib wird zweimal täglich oral mit einer Dosierung von 400 mg eingenommen. Die Wirksamkeit und Sicherheit des MET-TKI wurden unter anderem in der Phase-II-Studie GEOMETRY-mono-1 untersucht, die mehrere Kohorten therapienaiver bzw. vorbehandelter Patient*innen mit ALK- und EGFR-Wildtyp-NSCLC im Stadium IIIB/IV und METex14-Mutation bzw. MET-Amp umfasste. Die Studie war so konzipiert, dass Patient*innen je nach Therapielinie in unterschiedliche Kohorten eingeschlossen wurden und die jeweiligen Therapielinien unabhängig voneinander ausgewertet werden konnten. So betrug die ORR der Kohorte 4, die 69 Patient*innen mit METex14-mutiertem NSCLC und ein bis zwei vorangegangenen Therapien einschloss, 41 % (Abbildung 3). Die mediane Dauer des Ansprechens (mDOR) betrug 9,7 Monate, das mPFS 5,4 Monate und das OS 13,6 Monate. Therapienaive Patient*innen mit METex14-Mutation wurden in der Kohorte 5b untersucht, hier ergab sich für 28 Studienteilnehmer*innen eine ORR von 68 %, eine mDOR von 12,6 Monaten, ein mPFS von 12,4 Monaten und ein OS von 20,8 Monaten [Wolf et al. 2021, Wolf et al. 2020]. Diese Ergebnisse wurden in zwei Expansionskohorten mit vorbehandelten (Kohorte 6, n = 31) bzw. therapienaiven (Kohorte 7, n = 32) Patient*innen mit METex14-Mutation bestätigt (Kohorte 6: ORR: 52 %, mDOR: 8,4 Monate, mPFS: 6,9 Monate, OS: nicht erreicht; Kohorte 7: ORR: 66 %, mDOR: nicht erreicht, mPFS: 10,8 Monate, OS: nicht erreicht) [Wolf et al. 2021]. Zudem zeigte eine retrospektive Wirksamkeitsanalyse bei Patient*innen mit METex14-Mutation und Hirnmetastasen bei Studienbeginn ein intrakranielles Ansprechen bei 54 % der 13 Patient*innen mit auswertbaren Hirnläsionen. Davon wiesen vier einen vollständigen Rückgang aller Metastasen im Gehirn auf.
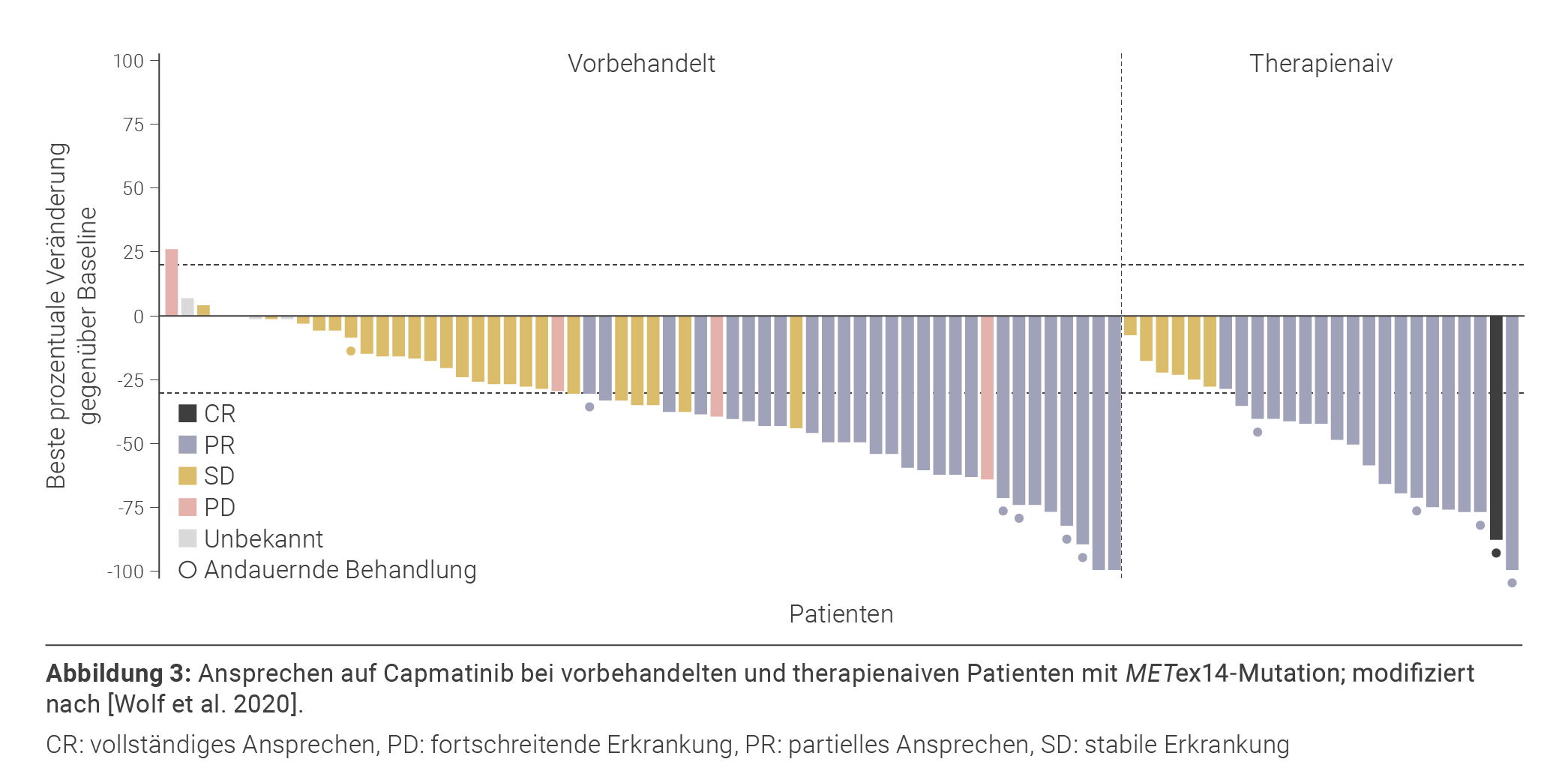
Das intrakranielle Ansprechen erwies sich als genauso schnell wie das systemische Ansprechen [Garon et al. 2020]. Die häufigsten unerwünschten Ereignisse (UE) der Sicherheitsanalyse, die 373 Studienteilnehmer *innen aller Kohorten einschloss, waren periphere Ödeme (54,2 %), Übelkeit (45 %), Erbrechen (28,2 %), erhöhtes Blutkreatinin (26,5 %), Dyspnoe (23,3 %), Fatigue (22,3 %) und verminderter Appetit (21,2 %). Insgesamt berichteten 98,4 % der Patient*innen von UE, unabhängig von deren Ursache [Wolf et al. 2021]. Zusammen stellen diese Daten die Grundlage der beantragten Zulassung von Capmatinib in Europa dar. Zudem wird aktuell die Wirksamkeit und Sicherheit von Capmatinib im Vergleich zu Docetaxel in der Phase-III-Studie GEOMETRY-III untersucht (Tabelle 1).
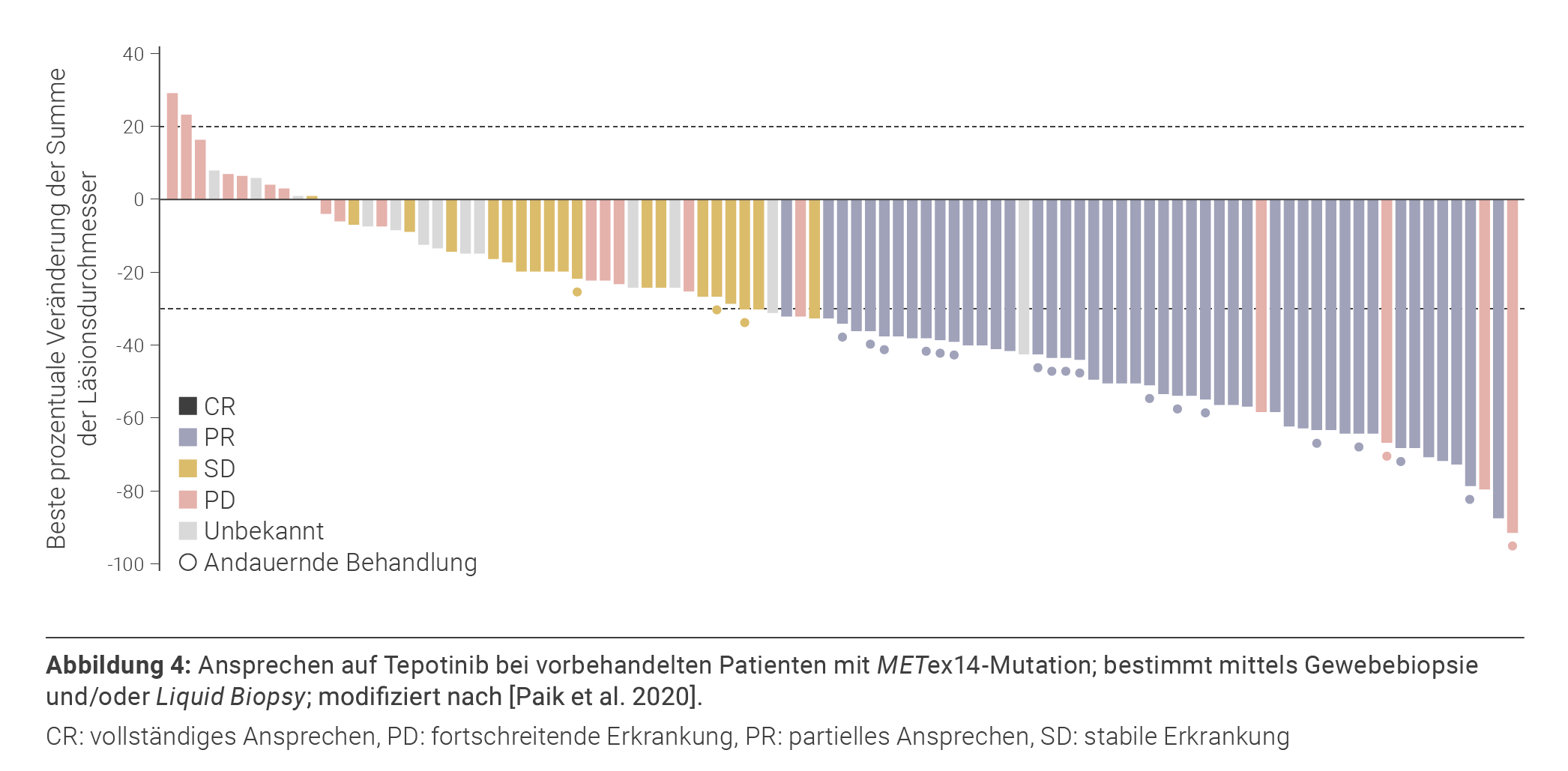
Tepotinib ist ein weiterer Typ-I-Inhibitor des MET- Rezeptors, der im Februar 2022 die Zulassung der EMA zur Behandlung erwachsener Patient*innen mit fortgeschrittenem METex14-mutiertem NSCLC und vorhergehender Immun- und/oder platinhaltiger Chemotherapie erhalten hat. Zuvor war der Wirkstoff bereits in mehreren Ländern außerhalb Europas zugelassen worden (Tabelle 1). Tepotinib wird einmal täglich oral mit einer Dosierung von 450 mg eingenommen. Die Wirksamkeit und Sicherheit wurden in der offenen Phase-II-Studie VISION untersucht. Gemäß dem Studienprotokoll wurden Patient*innen eingeschlossen, die basierend auf Liquid Biopsy oder Gewebebiopsie positiv auf die METex14-Mutation getestet wurden; eine Unterscheidung hinsichtlich der Therapielinien wurde hingegen nicht vorgenommen. Eine erste Auswertung schloss 152 Patient*innen mit fortgeschrittenem oder metastasiertem ALK- und EGFR-Wildtyp-NSCLC und METex14-Mutation ein. Bei Patient*innen mit einem Follow-up von mindestens neun Monaten (n = 99) betrug die durch unabhängige Gutachter*innen ermittelte ORR (primärer Endpunkt) 46 % (Abbildung 4) und die mDOR sowie das mPFS 11,1 bzw. 8,5 Monate. Patient*innen, die mittels Liquid Biopsy auf METex14-Mutationen getestet wurden, hatten eine ähnliche ORR (48 %) wie Patient*innen mit Gewebebiopsie (50 %). Bei elf Patient*innen mit Hirnmetastasen betrug die ORR 55 %. Das Ansprechen erfolgte meist innerhalb von sechs Wochen nach Beginn der Behandlung. Die Sicherheitsanalyse umfasste schließlich alle 152 Studienteilnehmer und ergab, dass bei einem Anteil von 98 % UE unabhängig von der Ursache auftraten. Am häufigsten (alle Grade) waren periphere Ödeme (63 %), Übelkeit (26 %) und Diarrhö (22 %) [Paik et al. 2020].
Savolitinib, ebenfalls ein Typ-I-Inhibitor des MET-Rezeptors, ist in China zur Therapie von Patient*innen mit METex14-mutiertem NSCLC bei Progress unter systemischer Therapie zugelassen. Alternativ kann der MET-TKI dort eingesetzt werden, wenn keine Chemotherapie möglich ist. Für Europa wurde bislang keine Zulassung bei der EMA beantragt. In einer offenen, multizentrischen Phase-II-Studie werden derzeit die Wirksamkeit und Sicherheit bei Patient*innen mit METex14-mutierten pulmonalen sarkomatoiden Karzinomen und anderen histologischen Subtypen des NSCLC untersucht.
Die Dosierung von Savolitinib erfolgt darin abhängig vom Körpergewicht und beträgt 600 mg oral einmal täglich für Personen ≥ 50 kg und 400 mg für Personen < 50 kg. Primärer Endpunkt der Studie ist die ORR gemäß einem unabhängigen Gutachter*innenkomittee. Eine erste Auswertung schloss 61 Patient*innen in die Wirksamkeitsanalyse ein und zeigte eine ORR von 47,5 % sowie eine Krankheitskon- trollrate (DCR) von 93,4 %. Die mDOR war noch nicht erreicht und das mPFS aller behandelten Patient*innen (n = 70) betrug 6,8 Monate. Die häufigsten UE (≥ 20 %) waren periphere Ödeme, Übelkeit, erhöhte Aspartat-Aminotransferase-(AST-)/Alanin-Aminotransferase-(ALT-)Werte, Erbrechen und Hypoalbuminämie. Bei 41,4 % der Patient*innen traten UE mit Grad ≥ 3 auf [Lu et al. 2020]. Eine Phase-III-Studie zur Wirksamkeit und Sicherheit von Savolitinib bei Patient*innen mit METex14-mutiertem NSCLC hat kürzlich mit der Rekrutierung begonnen und weitere Studien untersuchen aktuell die Kombination von Savolitinib mit Osimertinib (Tabelle 1).
6.3 TKI IN KLINISCHEN STUDIEN
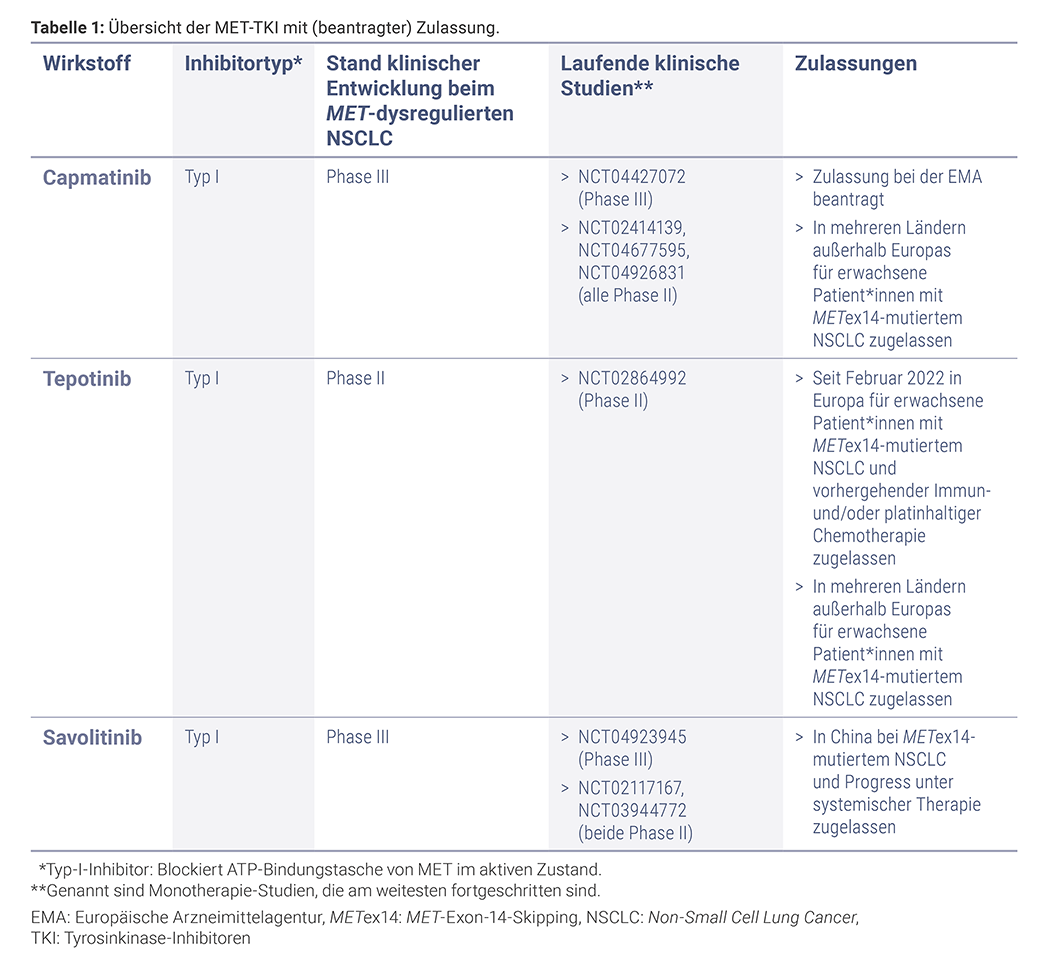
Eine Vielzahl an Substanzen wird in klinischen Studien hinsichtlich ihrer Wirksamkeit bei MET-dysreguliertem NSCLC untersucht. Im Folgenden werden die Wirkstoffe aufgeführt, die in ihrer Entwicklung am weitesten fortgeschritten sind.
Crizotinib, ein Typ-I-Inhibitor, zeigte als erster TKI eine Anti-Tumor-Aktivität beim METex14-mutierten NSCLC. Während der TKI bereits zur Therapie des ALK- bzw. ROS1-positiven NSCLC zugelassen ist, laufen aktuell verschiedene Phase-II-Studien zur Untersuchung der Wirksamkeit und Sicherheit bei Patient*innen mit MET-Dysregulation (NCT04084717, NCT02465060 [NCI- MATCH], NCT02664935 [National Lung Matrix Trial]).
Eine Übersicht weiterer MET-TKI in der klinischen Entwicklung gibt Tabelle 2.