ONKOGENE MET-ALTERATIONEN BEIM NICHT-KLEINZELLIGEN LUNGENKREBS
4. ALTERATIONEN DES MET-GENS BEIM NSCLC
Eine MET-Dysregulation kann auf verschiedenen Ursachen beruhen, dazu zählen sowohl genetische Alterationen, wie Exon-14-Skipping-Mutationen, Amplifikation und Fusionen/Translokationen, als auch eine Überexpression des Proteins. In den folgenden Abschnitten werden die einzelnen Alterationen näher beleuchtet.
4.1 METex14-MUTATIONEN
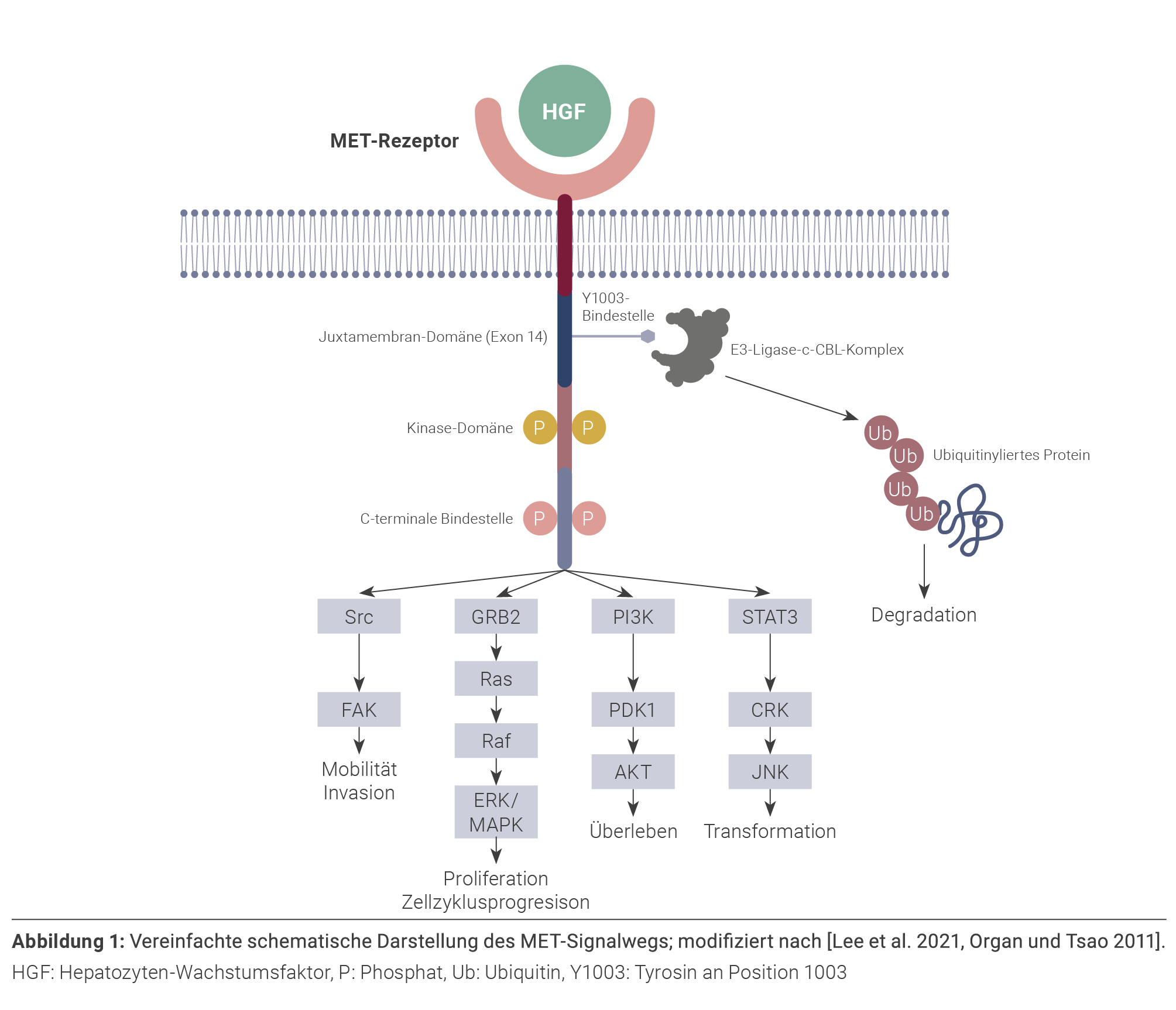
Die negative Regulation des MET-Signalwegs erfolgt
über die Bindung der E3-Ubiquitin-Ligase c-CBL an
das Tyrosin an Position 1.003 der Aminosäurekette
im Bereich der Juxtamembran-Domäne des Rezeptors. Diese Bindestelle wird von Exon 14 kodiert. Die
von c-CBL vermittelte Ubiquitinylierung induziert die
Degradation des Proteins und unterbindet damit eine
weitere Aktivierung der nachfolgenden Signalketten
(Abbildung 1) [Tan et al. 2021].
METex14-Mutationen umfassen eine heterogene
Gruppe genetischer Alterationen, die das korrekte
Splicen, d. h. die Entfernung der Introns aus der MET-pre-mRNA (pre-messenger RNA), beeinträchtigen. Als
Resultat geht neben den Introns auch das Exon 14
verloren, sodass die c-CBL-Bindestelle im translatierten
Protein fehlt. Die negative Regulation von MET durch
Ubiquitinylierung ist somit nicht mehr möglich [Guo et
al. 2020]. Inzwischen sind mehr als 120 Alterationen
bekannt, die zum Fehlen von Exon 14 führen, darunter überwiegen
Insertionen und Deletionen unterschiedlicher Länge
[Frampton et al. 2015, Guo et al. 2020].
Die Prävalenz von METex14-Mutationen bei Patient*innen mit NSCLC beträgt etwa 3 % – bei keiner anderen Krebsart wurde diese genetische Veränderung so häufig beobachtet [Frampton et al. 2015, Vuong et al. 2018]. 15 – 21 % der Patient*innen mit METex14-mutiertem NSCLC weisen gleichzeitig eine MET-Amp auf [Reungwetwattana et al. 2017]. Darüber hinaus sind METex14-Mutationen mit bestimmten Patient*innen- und Krankheitseigenschaften verbunden. So ergab eine Meta-Analyse, dass METex14-Mutationen gegenüber MET-Wildtyp-NSCLC mit einem höheren Erkrankungsalter assoziiert waren und hinsichtlich Geschlecht und Rauchgewohnheiten häufiger bei Frauen und Nichtraucher*innen auftraten [Vuong et al. 2018]. Zudem sind bestimmte histologische Subtypen häufiger betroffen: Wie eine Übersichtsarbeit zeigte, war in vielen Studien die Prävalenz bei adenosquamösen Karzinomen am höchsten, gefolgt von Adenokarzinomen, wohingegen der Anteil plattenepithelialer Karzinome mit METex14-Mutation sehr gering war [Reungwetwattana et al. 2017]. Eine solche genetische Veränderung war darüber hinaus ein negativer prognostischer Marker und mit einem schlechteren Gesamtüberleben (OS) assoziiert [Tong et al. 2016, Yeung et al. 2015]. Weitere Studienergebnisse weisen darauf hin, dass das Vorliegen einer METex14-Mutation mit einem schlechteren Ansprechen auf Immuntherapien einhergeht (s. Kapitel 6.1) [Mazieres et al. 2019].
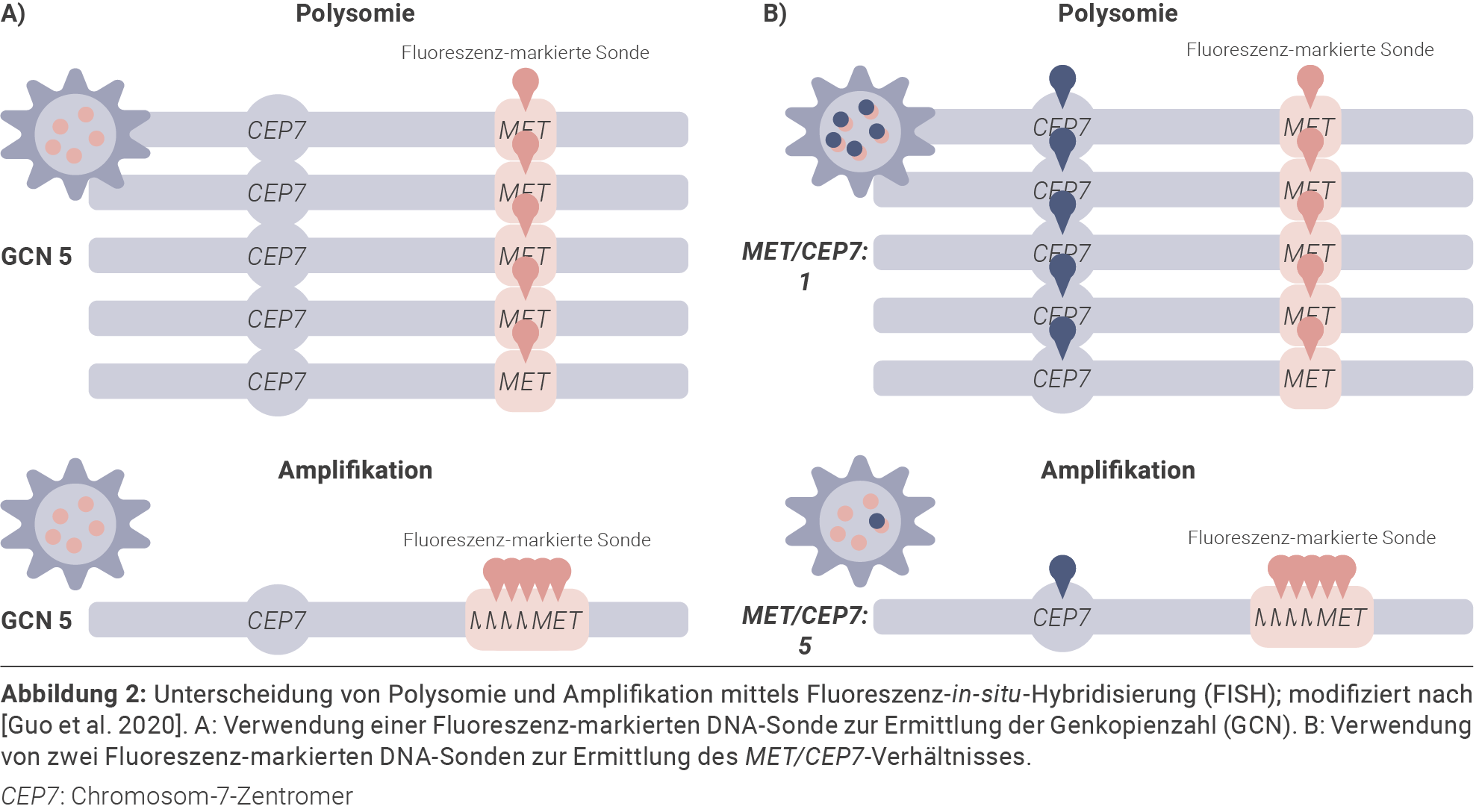
4.2 MET-AMP
Bei der MET-Amp handelt es sich um eine Erhöhung der Genkopienzahl (Gene Copy Number, GCN), die aus einer Vervielfältigung des regionalen oder fokalen DNA-Abschnitts, in dem das MET-Gen liegt, resultiert. Daneben kann eine Erhöhung der MET-GCN auch Folge einer Polysomie sein, in diesem Fall liegen mehr als zwei Kopien des gesamten Chromosoms 7 vor. Folglich werden sämtliche Gene dieses Chromosoms amplifiziert, darunter z. B. auch EGFR. Mithilfe des Verhältnisses aus MET-Genen und Chromosom-7-Zentromeren (MET/CEP7) kann zwischen einer Polysomie und einer wahren MET-Amp unterschieden werden (s. Abbildung 2 und Kapitel 5.2). Eine MET-Amp wurde bereits in zahlreichen Krebsarten nachgewiesen, beim NSCLC wird die Prävalenz mit bis zu 5 % angegeben [Guo et al. 2020]. Übereinstimmende Patient*innencharakteristika können aufgrund fehlender diagnostischer Standards (s. Kapitel 5.2) noch nicht herausgearbeitet werden. Insgesamt zeigte sich beim NSCLC keine starke Assoziation mit den Rauchgewohnheiten der Patient*innen [Guo et al. 2020]. Eine GCN ≥ 10 in der Gewebebiopsie trat laut einer Studie von Overbeck et al. ausschließlich in schlecht differenzierten Adenokarzinomen auf, ging selten mit Co-Mutationen einher und war mit einem verkürzten OS und einem größeren Sterberisiko verbunden [Overbeck et al. 2020].
In einer anderen Studie trat eine geringgradige MET-Amp (2 ≤ MET/CEP7 < 5) oder Polysomie im Tumorgewebe gemeinsam mit EGFR- oder KRAS-Mutationen auf. Eine hochgradige MET-Amp (MET/CEP7 ≥ 5) ging hingegen nicht mit anderen Co-Mutationen außer METex14-Mutationen einher und war mit einer schlechteren Prognose verbunden [Tong et al. 2016]. Die MET-Amp spielt zudem eine wichtige Rolle bei akquirierten TKI-Resistenzen. So wurde diese genetische Alteration bei 5 – 20 % der Patient*innen mit einer EGFR-TKI-Resistenz identifiziert und stellt die häufigste Ursache für eine sogenannte Bypass-Aktivierung dar, wobei der durch einen TKI gehemmte Signalweg von einem alternativen Signalweg umgangen wird [Guo et al. 2020, Leonetti et al. 2019]. Dies ist ein Beispiel für einen Off-Target-Mechanismus, wohingegen On-Target-Resistenzen durch Alterationen in dem von einer zielgerichteten Therapie adressierten Gen hervorgerufen werden. Die MET-Amp ist unter anderem für die erworbene, d. h. therapieinduzierte, und eventuell auch die intrinsische, d. h. vorbestehende, Resistenz gegen Osimertinib, einen EGFR-TKI der dritten Generation, verantwortlich. Daraus ergab sich die Rationale für eine Kombinationstherapie aus Osimertinib und MET-Inhibitoren, die derzeit in klinischen Studien untersucht wird [Leonetti et al. 2019]. Darüber hinaus wird der MET-Amp auch eine Rolle bei der ALK-TKI-Resistenz zugeschrieben, die jedoch bislang weniger genau untersucht ist [Guo et al. 2020].
4.3 MET-FUSION/TRANSLOKATION
MET-Fusionen entstehen durch intra- oder interchromosomale Translokation sowie durch para- oder perizentrische Inversionen. Die resultierenden Fusionsproteine bestehen typischerweise aus der MET-Kinase-Domäne sowie einer Dimerisierungsdomäne des Fusionspartners, welche die konstitutive, Liganden-unabhängige Aktivierung der Kinasefunktion induziert [Guo et al. 2020]. Die Prävalenz von MET-Fusionen beim NSCLC ist sehr niedrig und beträgt circa 0,5 % der Lungen-Adenokarzinome, die keine anderen molekularen Treiber aufweisen. Entsprechend unklar ist bislang die klinische und prognostische Relevanz dieser Alteration [Lee et al. 2021].
4.4 MET-ÜBEREXPRESSION
Eine erhöhte MET-Proteinmenge kann zum einen die Folge von METex14-Mutationen oder MET-Amp sein, doch auch in Abwesenheit dieser genetischen Veränderungen ist eine MET-Überexpression möglich. Dies geschieht auf Ebene der Transkription und kann durch Ereignisse wie Hypoxie und Entzündung hervorgerufen werden [Guo et al. 2020]. Mit einem Anteil von 35 – 72 % aller NSCLC ist die Prävalenz zwar sehr hoch, jedoch korreliert die beobachtete Überexpression nicht mit der MET-Aktivität [Lee et al. 2021]. Auch die Bedeutung als onkogener Biomarker ist bislang unklar [Lee et al. 2021].