CHIMÄRE-ANTIGENREZEPTOR-(CAR-)T-ZELLEN ZUR BEHANDLUNG DES REFRAKTÄREN ODER REZIDIVIERTEN DIFFUSEN GROẞZELLIGEN B-ZELL-LYMPHOMS
6 DETERMINANTEN FÜR ANSPRECHEN UND OPTIMIERUNGSMÖGLICHKEITEN
6.1 IDENTIFIKATION UND ERFASSUNG RELEVANTER KLINISCHER PARAMETER
US-amerikanische Konsortien konnten in großen Patient:innenkohorten darlegen, dass Betroffene, die mehrheitlich nicht die Einschlusskriterien der Zulassungsstudien erfüllten, unter der CAR-T-Zelltherapie trotzdem ein sehr ähnliches Wirksamkeitsprofil zeigen konnten [Nastoupil et al. 2020]. Dies lässt vermuten, dass nicht die Studieneinschlusskriterien für den Therapieerfolg einer CAR-T-Zelltherapie ausschlaggebend sind, sondern zusätzliche klinische Parameter, wie z. B.:
- Tumorlast [Voorhees et al. 2022],
- Laktatdehydrogenase-(LDH-)Wert [Bethge et al. 2022, Rabinovich et al. 2021] als Surrogat für Tumorgröße, Krankheitsdynamik und ein immunsuppressives Milieu (s. u.),
- immunsuppressives Tumormikromilieu (z. B. vermehrte Expression immunologischer Checkpointmoleküle wie PD-L1, Infiltration mit immunsuppressiven Makrophagen bzw. zirkulierende myeloide Suppressorzellen) [Chong et al. 2017, Jain et al. 2021a] und
- spezifische genomische Aberrationen, wie z. B. Marker für genomische Komplexität [Jain et al. 2021b].
Idealerweise sollten bei einer innovativen Therapie wie den CAR-T-Zellen diese (und weitere) Biomarker systematisch erfasst werden. Das gilt natürlich auch für die gewählten Modalitäten zur Erfolgsbewertung der Therapie (PET-CT vs. CT) und die Zeitpunkte bzw. Intervalle der Untersuchungen. Nur so lassen sich Daten verschiedener Zentren vergleichen und daraus ggf. Interventionsstrategien ableiten, wie man die Ausgangsbedingungen der Patient:innen so verbessert, dass die volle Effektivität der CAR-T-Zelltherapie ausgeschöpft wird [Cahill et al. 2020]. Dazu könnte der frühere Einsatz von CAR-T-Zellen und eine Optimierung der Bridging-Strategien gehören, wie im Verlauf kurz erläutert wird.
6.2 FRÜHER EINSATZ VON CAR-T-ZELLEN
Erfahrungen aus dem Klinikalltag haben gezeigt, dass Patient:innen, die CAR-T-Zellen erhalten, oft in einem reduzierten klinischen Zustand (mit z. B. hoher Tumorlast) sind und bereits mehr als drei Therapielinien inklusive autologer SZT erhalten haben [Amini et al. 2022, Bethge et al. 2021]. Viele dieser Parameter gehen mit einer schlechteren Wirksamkeit einher, zudem können stark lymphotoxische Vorbehandlungen eine Herstellung von CAR-T-Zellen beeinträchtigen bzw. unmöglich machen. Aus diesem Grund ist es besonders wichtig, mit CAR-T-Zentren frühzeitig in Kontakt zu treten, um gemeinsam Behandlungspfade abzustimmen und eine CAR-T-Zelltherapie so früh, wie es die Zulassung und der klinische Zustand erlauben, einzuleiten. Zudem werden bereits Konzepte zur vorsorglichen Leukapherese mit Einlagerung von T-Zellen für eine etwaige zukünftige CAR-T-Zell-Herstellung diskutiert, wobei dafür die klinischen Daten (noch) fehlen bzw. viele Fragen bzgl. der Umsetzbarkeit offen sind [Amini et al. 2022]. Bei der Behandlung von Lymphomen wird der Einsatz einer CAR-T-Zelltherapie bereits als Erstlinientherapie mit der Hoffnung erprobt, dass sich Wirksamkeit sowie Erfolgsaussichten weiter verbessern [Neelapu et al. 2022].
6.3 OPTIMIERUNG DER BRIDGING- STRATEGIEN
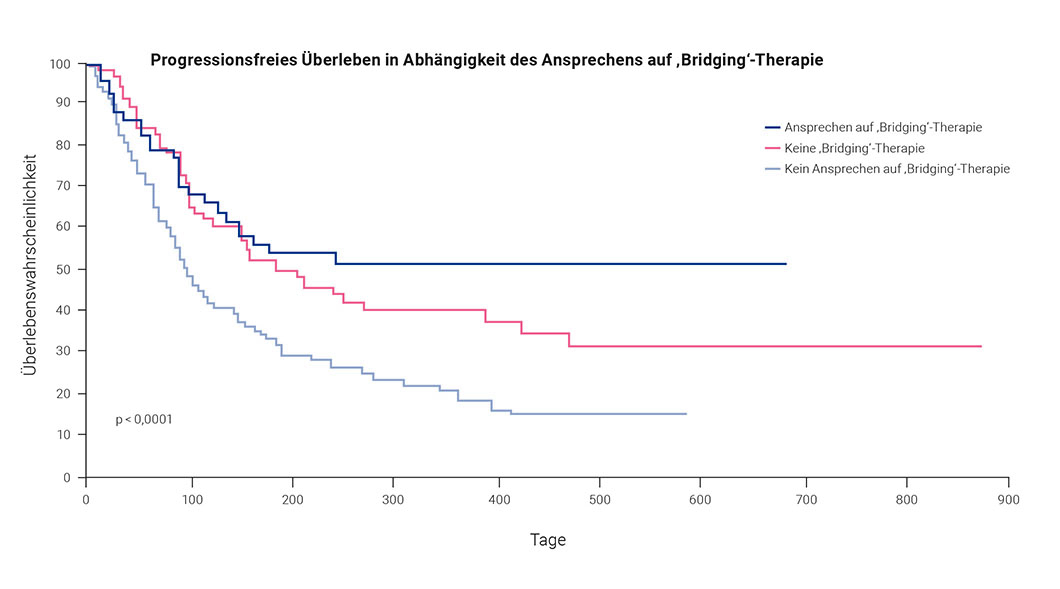
Zeit ist ein wichtiger Faktor in der CAR-T-Zelltherapie. Zwischen der Entscheidung in einem interdisziplinären Tumorboard bis zur Infusion können mehrere Wochen vergehen. In diesem Zeitraum muss in vielen Fällen eine sehr aggressive Erkrankung, die ggf. schon chemorefraktär ist, stabil gehalten werden. Da die Tumorlast vor dem adoptiven Transfer invers mit der Wirksamkeit und positiv mit behandlungsassoziierten Nebenwirkungen korreliert, sollte durch eine Bridging-Therapie idealerweise nicht nur eine Stabilisierung, sondern eine Senkung der Tumorlast erreicht werden. Eine aktuelle Studie der German Lymphoma Alliance (GLA) konnte dazu zeigen, dass vor allem das Ansprechen auf die Bridging-Therapie entscheidend dafür ist, ob eine nachfolgende CAR T-Zelltherapie wirkt (Abbildung 9) [Bethge et al. 2021].
Zurzeit besteht allerdings kein Konsens bzgl. der optimalen Bridging-Strategie. Zudem spielen patient:innenindividuelle Faktoren sicherlich eine große Rolle [Amini et al. 2022]. Dabei muss auch der potenzielle Einfluss der Therapie u. a. auf CRS und ICANS durch die kumulative Toxizität berücksichtigt werden. Es ist jedoch abzusehen, dass durch eine effektivere Bridging-Therapie gleichzeitig auch die Wirksamkeit der CAR-T-Zellen verbessert wird. Hier könnten neue Substanzen wie z. B. bispezifische Antikörper, Immunotoxine oder Immunmodulatoren (zur Remodellierung der Tumormikromilieus) eine wichtige Rolle spielen.
CAR: chimärer Antigenrezeptor