CHIMÄRE-ANTIGENREZEPTOR-(CAR-)T-ZELLEN ZUR BEHANDLUNG DES REFRAKTÄREN ODER REZIDIVIERTEN DIFFUSEN GROẞZELLIGEN B-ZELL-LYMPHOMS
3 VERFÜGBARE BEHANDLUNGSOPTIONEN FÜR PATIENT:INNEN MIT DLBCL
3.1 ERSTE THERAPIELINIE
Das DLBCL ist durch den Einsatz einer sequenziellen und kombinierten Polychemotherapie nach dem CHOP- Schema (Cyclophosphamid, Doxorubicin, Vincristin, Prednison) zusammen mit dem monoklonalen Anti-CD20-Antikörper Rituximab (R-CHOP) grundsätzlich heilbar (60 – 70 % der Patient:innen) [Pfreundschuh et al. 2011, Pfreundschuh et al. 2008, Schmitz et al. 2012]. Zusätzlich zur o. g. Standardtherapie mit in der Regel sechs Zyklen R-CHOP werden in der aktuellen Leitlinie als Alternativen in der Erstlinientherapie auch komplexere Behandlungsoptionen empfohlen, die bei einer Therapiestratifizierung nach unterschiedlichen Risikofaktoren, wie z. B. dem altersadjustierten IPI (aaIPI) und dem Alter der Patient:innen, zum Tragen kommen (Abbildung 1). So hat sich bei Patient:innen ≤ 60 Jahren mit intermediärer Prognose (aaIPI 1) das R-ACVBP-Protokoll (Rituximab, Doxorubicin, Cyclophosphamid, Vindesin, Bleomycin und Prednison) dem R-CHOP-Protokoll signifikant überlegen erwiesen [Recher et al. 2011]. Bei jüngeren Patient:innen mit ungünstiger Prognose (aaIPI 2 – 3) wurden mit der Hinzunahme von Etoposid zum R-CHOP-Protokoll (R-CHOEP) gute Ergebnisse erzielt [Schmitz et al. 2012]. In einer aktuellen Studie mit DLBCL-Patient:innen mit erhöhtem Risiko (IPI 2 – 5) zeigten sechs Gaben R-CHP in Kombination mit dem gegen CD79a gerichteten Antikörper-Wirkstoff-Konjugat Polatuzumab-Vedotin (zusammen Pola-R-CHP) gefolgt von zwei Applikationen Rituximab im Vergleich zur Standardtherapie mit sechs Gaben R-CHOP und zwei Applikationen Rituximab ein signifikant verbessertes progressionsfreies Überleben (PFS) [Tilly et al. 2021].
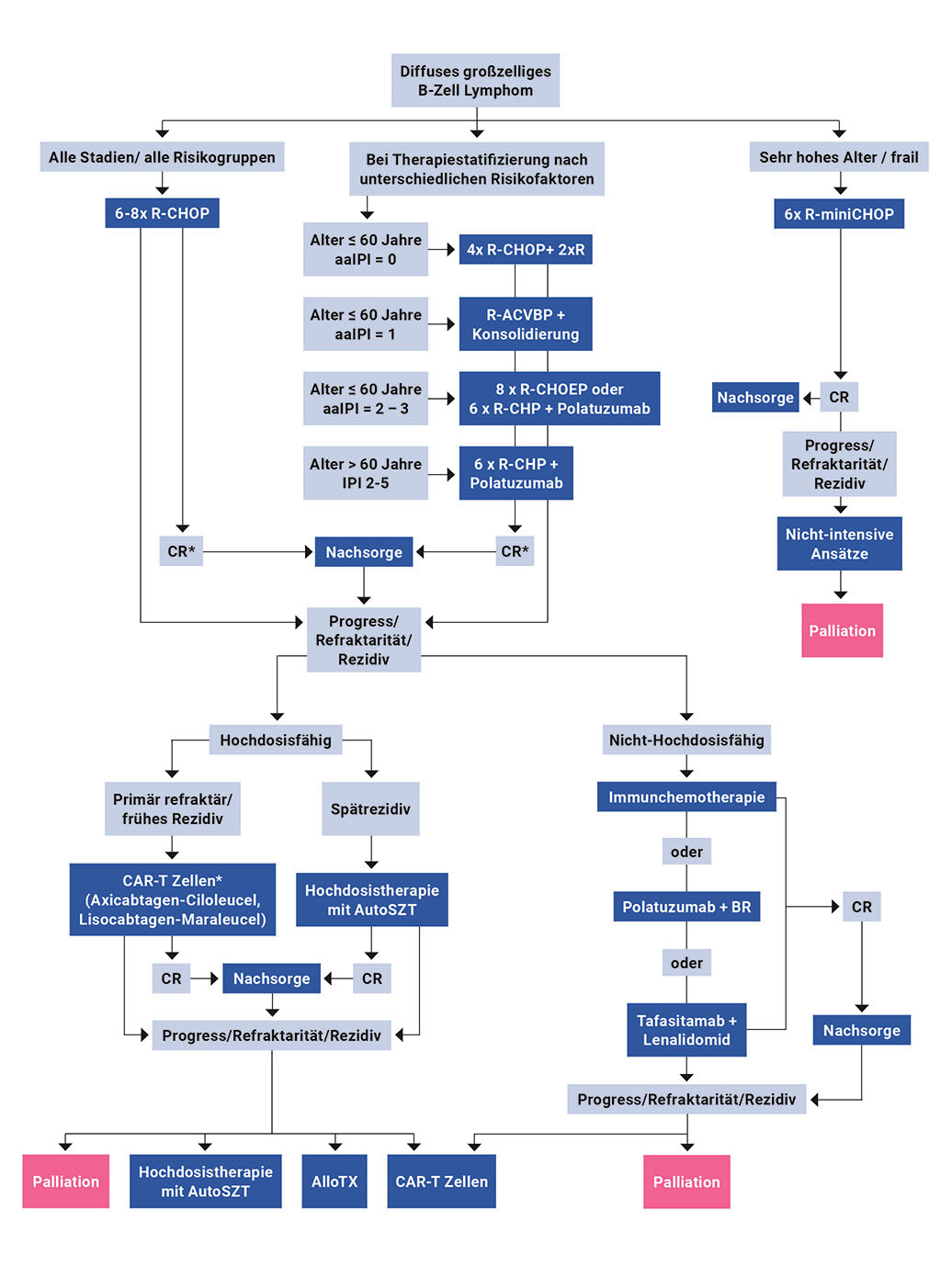
ACVBP: Chemotherapie-Schema bestehende aus Doxorubicin, Cyclophosphamid, Vindesin, Bleomycin und Prednison; aaIPI: altersadjustierter International Progonostic Index; AutoSZT: autologe Stammzelltransplantation; BR: Bendamustin-Rituximab; CAR: chimärer Antigenrezeptor; CHOP: Chemotherapie-Schema bestehend aus Cyclophosphamid, Doxorubicin, Vincristin und Prednison; CHOEP: CHOP plus Etoposid; CR: Komplettremission; IPI: International Progonostic Index; miniCHOP: dosisreduzierte CHOP; R: Rituximab
3.2 THERAPIEOPTIONEN FÜR REZIDIVIERTE BZW. PRIMÄR REFRAKTÄRE DLBCL-ERKRANKUNGEN
Als Standardtherapie für Rezidive galt bei jüngeren Patient:innen (unterhalb des 60. Lebensjahrs), aber auch bei älteren Betroffenen ohne therapielimitierende Komorbiditäten in den letzten Jahrzenten eine Salvage-Chemotherapie (i. d. R. Dexamethason, hoch dosiertes Cytarabin, Cisplatin plus Rituximab [R-DHAP] oder Gemcitabin, Dexamethason, Cisplatin plus Rituximab [R-GDP] oder Ifosfamid, Etoposid, Carboplatin plus Rituximab [R-ICE]) gefolgt von einer Hochdosischemotherapie (z. B. Carmustin, Etoposid, Cytarabin und Melphalan [BEAM]). Diese wurde dann meist durch eine Transplantation mit autologen Stammzellen konsolidiert [Crump et al. 2014, Gisselbrecht et al. 2010, van Imhoff et al. 2017]. Befriedigende Ergebnisse waren jedoch nur dann zu erwarten, wenn das Rezidiv auf die Induktionstherapie ansprach. Bei einem Intervall unter zwölf Monaten zwischen Primärdiagnose und Rezidiv war dies nur selten der Fall.
Für jüngere hochdosisfähige Patient:innen mit refraktärer oder früh rezidivierter Erkrankung wurde in jüngster Vergangenheit der aktuelle Standard einer Hochdosistherapie gefolgt von einer autologen Stammzelltransplantation (SZT) in drei Phase-III-Studien direkt mit einer CD19-spezifischen CAR-T-Zelltherapie verglichen [NCT03391466, NCT03570892, NCT03575351]. In Anbetracht der Resultate dieser Studien kann laut aktueller Leitlinie eine Behandlung mit einem von zwei CD19-spezifischen CAR-T-Zell-Produkten – nach Zulassung und Kostenübernahme – als neuer Standard bei Patient:innen mit primär refraktärer Erkrankung oder frühem Rezidiv (früher als zwölf Monate nach Beendigung der Erstlinientherapie) angesehen werden [Lenz 2022]. Für das Produkt Axicabtagen-Ciloleucel liegt seit dem 17.10.2022 die Zulassung der Europäischen Kommission für die Zweitlinientherapie des DLBCL vor [EC 2022]. Dabei zeigte die ZUMA-7-Studie mit Axicabtagen-Ciloleucel signifikant verbesserte Ergebnisse gegenüber der bisherigen Standardtherapie bei der Behandlung von rezidivierten oder refraktären DLBCL-Patient:innen [Locke et al. 2022].
Patient:innen, die für eine Transplantation autologer oder allogener Stammzellen bzw. eine CAR-T-Zelltherapie nicht geeignet sind, werden häufig palliativ behandelt. Eine kurative Therapie kann möglich sein, wenn der Zeitraum zwischen der Primärdiagnose und dem Rezidiv über zwölf Monate beträgt und ein Ansprechen auf die erneute Immunchemotherapie nachgewiesen werden kann. Dabei können neben dem R- GemOx-Protokoll (Gemcitabin, Oxaliplatin plus Rituximab) auch die bereits erwähnten Protokolle R- DHAP oder R-ICE eingesetzt werden [El Gnaoui et al. 2007]. Weiterhin ist die Kombination aus Rituximab, Bendamustin plus Polatuzumab-Vedotin (Pola-BR) bei rezidivierten DLBCL-Patient:innen, die nicht für eine Stammzelltransplantation geeignet sind, zugelassen. Im Rahmen der Zulassungsstudie konnte für den Versuchsarm mit Pola-BR im Vergleich zum Versuchsarm mit Rituximab und Bendamustin eine signifikante Verbesserung der Gesamtansprechraten (ORR), des PFS und des Gesamtüberlebens (OS) gezeigt werden [Sehn et al. 2020]. Kürzlich wurde für diese Patient:innengruppe zudem der monoklonale Anti-CD19-Antikörper Tafasitamab in Kombination mit dem immunmodulierenden Wirkstoff (IMiD) Lenalidomid zugelassen [EMA 2022a]. Aktuelle Daten der zulassungsrelevanten Studie L-MIND zeigen nach ≥ 35 Monaten Nachbeobachtung eine ORR von 58 %, die sich aus 40 % vollständiger Remission (CR) sowie 18 % partieller Remission (PR) zusammensetzt [Duell et al. 2021]. Am 15. September 2022 empfahl der Ausschuss für Humanarzneimittel der Europäischen Zulassungsbehörde (CHMP) die Zulassung von Loncastuximab-Tesirin ab der dritten Therapielinie als Monotherapie für die Behandlung von erwachsenen Patient:innen mit diffusem großzelligem rezidiviertem oder refraktärem B-Zell-Lymphom und hochgradigem B-Zell-Lymphom [EMA 2022b]. Die Empfehlung basiert auf den Ergebnissen der LOTIS-2-Studie, einer multinationalen, einarmigen klinischen Phase-II-Studie zu Loncastuximab-Tesirin als Behandlungsoption für erwachsene Patient:innen mit rezidiviertem oder refraktärem DLBCL nach zwei oder mehr vorausgegangenen systemischen Therapielinien [NCT03589469]. Die Marktzulassung wird demnächst erwartet (Stand: November 2022).
Laut aktueller Leitlinie sollte jedoch bei Patient:innen ab dem 2. Rezidiv immer die Möglichkeit einer Zelltherapie mit CAR-T-Zellen geprüft werden [Lenz 2022].