CHIMÄRE-ANTIGENREZEPTOR-(CAR-)T-ZELLEN ZUR BEHANDLUNG DES REFRAKTÄREN ODER REZIDIVIERTEN DIFFUSEN GROẞZELLIGEN B-ZELL-LYMPHOMS
5 ÜBERSICHT ZUGELASSENER CAR-T-ZELLTHERAPIEN FÜR DAS DLBCL AB DER DRITTEN BEHANDLUNGSLINIE
5.1 EIGENSCHAFTEN DER KONSTRUKTE, HERSTELLUNG UND ZUSAMMENSETZUNG DER VERSCHIEDENEN CD19-SPEZIFISCHEN CAR-T-ZELL-PRODUKTE
Für die Behandlung eines r/r DLBCL sind ab der dritten Behandlungslinie aktuell drei CAR-T-Zell-Produkte zugelassen: Axicabtagen-Ciloleucel (Axi-Cel), Lisocabtagen-Maraleucel (Liso-Cel) und Tisagenlecleucel (Tisa-Cel) [Abramson et al. 2020, Neelapu et al. 2017, Schuster et al. 2019]. Der Aufbau der CAR-Konstrukte weist Unterschiede auf (Abbildung 6): Während alle drei Produkte dieselbe Bindedomäne des CD19-spezifischen Antikörpers FMC63 aufweisen [Zola et al. 1991], besitzen sie unterschiedliche kostimulatorische Domänen (41BB bei Tisa-Cel und Liso-Cel sowie CD28 bei Axi-Cel). Wie oben beschrieben, hat die Art der Kostimulation eine In-vivo-Relevanz. So zeigen Daten aus präklinischen Studien, dass 41BB im Vergleich zu CD28 zu einer geringeren Erschöpfung von T-Zellen führt [Long et al. 2015]. Dagegen scheinen CAR-T-Zellen mit kostimulatorischer CD28-Domäne bei geringer Ziel-Antigenexpression auf den Tumorzellen besser zu wirken [Majzner et al. 2020].
Für die genetische Modifikation der T-Zellen werden bei der Herstellung von Axi-Cel retrovirale Vektoren eingesetzt, bei Liso-Cel und Tisa-Cel sind es lentivirale Vektoren. Für die Herstellung von Axi-Cel und Tisa-Cel werden T-Zellen nach der Leukapherese nicht weiter separiert. Bei Liso-Cel werden CD4- und CD8-positive T-Zellen isoliert und getrennt voneinander transduziert und weiterverarbeitet. Im finalen Produkt wird ein ausgeglichenes Verhältnis von CD4- und CD8-positiven CAR-T-Zellen angestrebt, was sich positiv auf das Nebenwirkungsprofil auswirken soll [Abramson et al. 2020, Turtle et al. 2016]. Ob sich das 1:1-Verhältnis von T-Zellpopulationen auch positiv auf die Wirksamkeit auswirkt, ist noch ungeklärt [Oluwole et al. 2020].
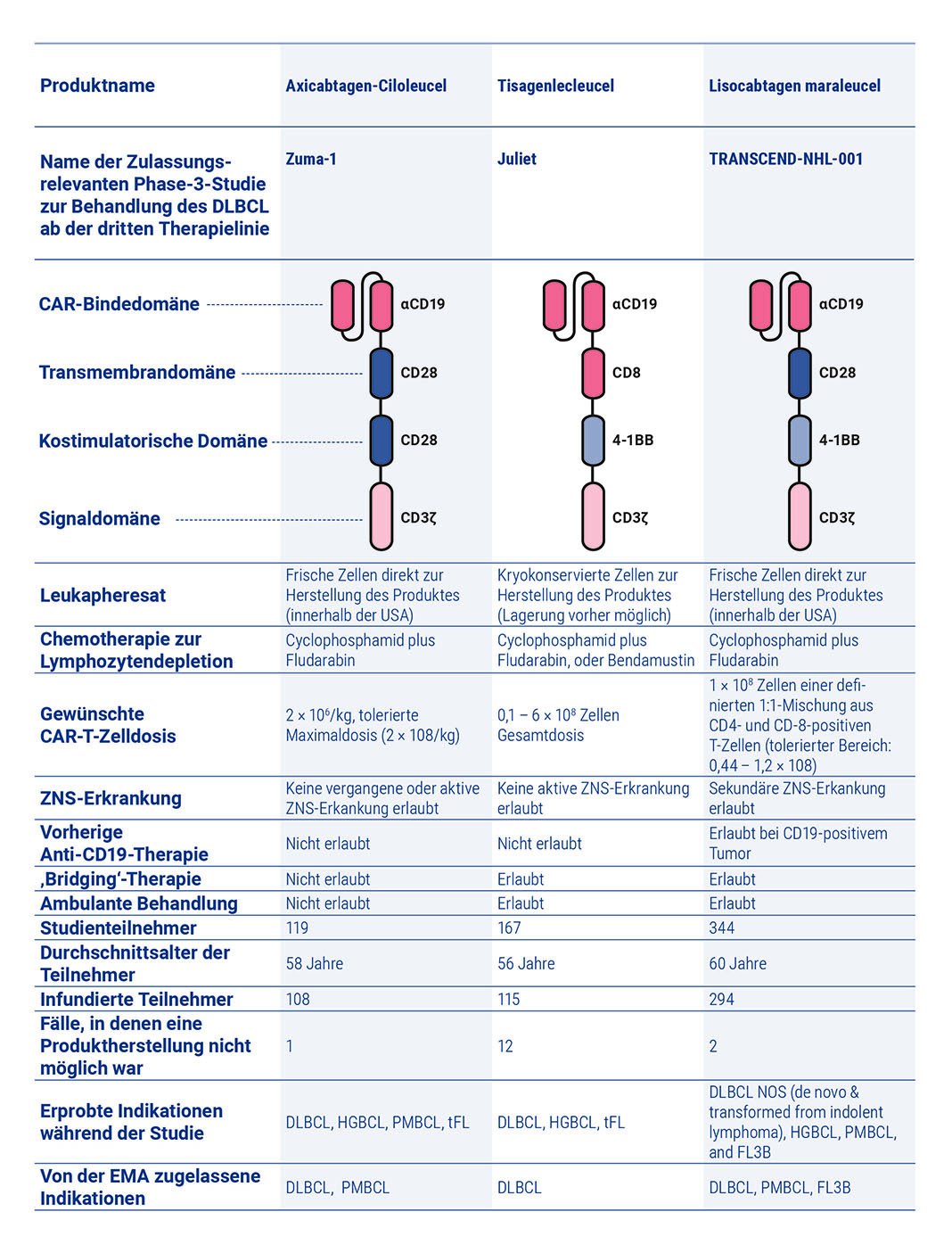
CAR: chimärer Antigenrezeptor; DLBCL: diffus großzelliges B-Zell-Lymphom (Diffuse Large B-Cell Lymphoma); EMA: Euro päische Arzneimittel-Agentur; FL3B: follikuläres Lymphom Grad 3b; HGBCL: High Grade B-Cell Lymphoma; NOS: nicht weiter spezifiziert (Not Otherwise Spe cified ); PMBCL: primär mediastinales groß zelliges B-Zell-Lymphom (Primary Mediastinal B-Cell Lymphoma); tFL: transformiertes follikuläres Lymphom; ZNS: zentrales Nervensystem
5.2 ZULASSUNGSSTUDIEN ZUR WIRKSAMKEIT UND SICHERHEIT AB DER DRITTEN BEHANDLUNGSLINIE DES DLBCL
5.2.1 Tisagenlecleucel (Tisa-Cel)
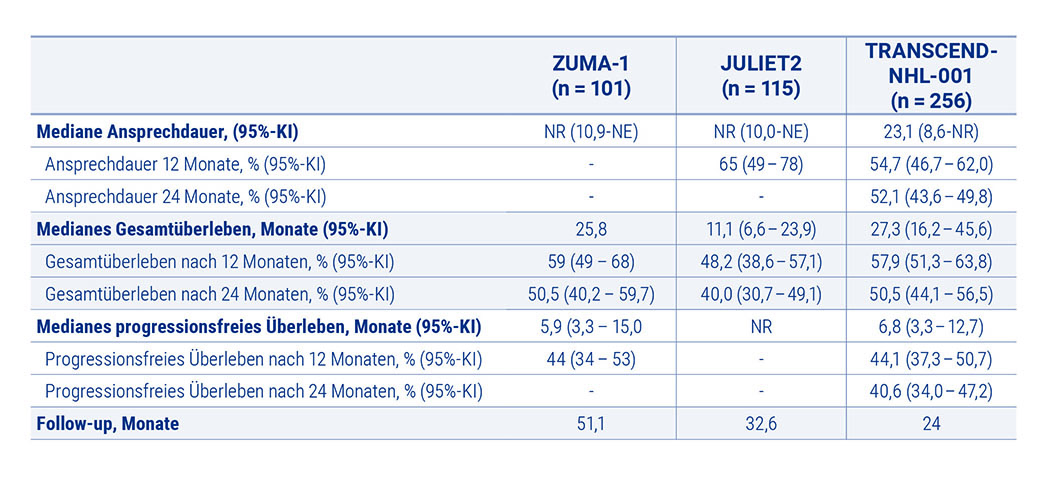
In der JULIET-Studie wurden insgesamt 111 r/r-DLBCL Patient:innen für eine Behandlung mit Tisa-Cel eingeschlossen [Schuster et al. 2019]. Laut aktuellen Daten des 3-Jahres-Follow-ups mit 115 analysierten Proband:innen sprachen 53 % auf die Therapie an, dabei erreichten 39 % eine CR. Von acht Patient:innen, die zu Monat 3 nach Behandlung ein partielles Ansprechen aufwiesen, konvertierten fünf im Laufe der Nachbeobachtung zu einer CR. Das mediane PFS betrug für alle Teilnehmer:innen 2,9 Monate, dagegen wurde das mediane PFS bei den Patient:innen, die eine CR aufwiesen, noch nicht erreicht. CAR-T-Zellen konnten bis zu dreieinhalb Jahre im peripheren Blut der ansprechenden Patient:innen nachgewiesen werden [Schuster et al. 2021].
5.2.2 Axicabtagen-Ciloleucel (Axi-Cel)
Die Zulassung von Axi-Cel für die Behandlung von r/r DLBCL basiert auf den Ergebnissen der ZUMA- 1-Studie mit 108 Patient:innen [Neelapu et al. 2017]. Anders als in den Zulassungsstudien der anderen beiden CAR-T-Zell-Produkte war bei ZUMA-1 eine Bridging-Therapie ein Ausschlusskriterium. Die ORR lag bei 82 % mit einer CR-Rate von 58 % nach einer mittleren Nachbeobachtungszeit von 15,4 Monaten. Die Remissionen waren bei 42 % der Proband:innen anhaltend, wobei die Anzahl der Remissionen genauso wie die Anzahl der Patient:innen mit nachweisbaren zirkulierenden CAR-T-Zellen im zeitlichen Verlauf der Studie abnahm. Nach zwei Jahren Follow-up betrug die ORR 83 %. 58 % der Teilnehmer:innen wiesen eine Komplettremission auf und 39 % verblieben progressionsfrei. In 66 % der Fälle konnten CAR-T-Zellen und in 75 % der Fälle B-Zellen detektiert werden [Locke et al. 2019].
5.2.3 Lisocabtagen-Maraleucel (Liso-Cel)
Auch für Liso-Cel konnten in der zulassungsrelevanten TRANSCEND-NHL-001-Studie unter den 270 teilnehmenden Patient:innen mit einem r/r DLBCL anhaltende Remissionen beobachtet werden [Abramson et al. 2020]. Die Auswertung von 257 Teilnehmer:innen (42 % davon ≥ 65 Jahre) nach 24 Monaten zeigte ein Gesamtansprechen von 73 % mit einer CR bei 53 %. Die 2-Jahres-Rate zum anhaltenden Ansprechen lag bei 50 % und das 2-Jahres-PFS bei 41 %. Nach 24 Monaten betrug das Gesamtüberleben 51 % [Abramson et al. 2021].
In Tabelle 1 sind die Resultate der CAR-T-Zelltherapie in der dritten Therapielinie des DLBCL im Rahmen der zulassungsrelevanten klinischen Studien zusammengefasst.
5.3 STUDIEN ZUM EINSATZ VON CAR-T-ZELLEN IN FRÜHEREN BEHANDLUNGSLINIEN
In den Zulassungsstudien für die Behandlung von Patient:innen mit r/r DLBCL waren die CAR-T-Zell-Produkte im Median erst nach drei vorherigen Behandlungen eingesetzt worden [Westin et al. 2021]. Die trotz intensiver Vorbehandlung (mit ggf. auch negativem Einfluss auf die Qualität der T-Zellen) guten Ansprechraten und teilweise langanhaltenden Remissionen in einer bisher schwer zu behandelnden Patient:innengruppe waren die Rationale dafür, einen früheren Einsatz der CAR-T- Zelltherapie zu explorieren [Crump et al. 2017]. Daher wurde in jüngster Vergangenheit die Wirksamkeit von CAR-T-Zellen im Vergleich zur oben beschriebenen Standard-Zweitlinientherapie (bestehend aus Salvage-Chemoimmuntherapie sowie Hochdosis-Chemotherapie gefolgt von einer autologen SZT) untersucht. Dabei wurden in drei klinischen Phase-III-Studien die CD19-spezifischen CAR-T-Zell-Produkte Axi-Cel, Liso- Cel und Tisa-Cel getestet [NCT03391466, NCT03570892, NCT03575351]. Basierend auf den Resultaten dieser Studien erhielten zwei Produkte eine Empfehlung in der aktuellen deutschen Leitlinie zur Zweitlinientherapie des DLBCL [Lenz 2022]. Davon ist Axi-Cel seit dem 17.10.2022 von der EMA zugelassen [EC 2022].
Darüber hinaus finden bereits erste Studien mit CAR- T-Zellen als Erstlinientherapie bei Hochrisiko-DLBCL- Patient:innen statt [NCT03761056].
5.4 SICHERHEITSPROFILE DER VERSCHIEDENEN CAR-T-ZELL-PRODUKTE
Die Raten schwerwiegender Nebenwirkungen wie CRS und Neurotoxizität variieren zwischen den unterschiedlichen Studien mit unterschiedlichen CAR-T-Zell-Produkten. Ein Grund dafür liegt sicherlich auch in den uneinheitlichen Definitionen und Bewertungen der Schweregrade. Im Allgemeinen zeigen CAR-T-Zellen mit CD28-Signaldomänen höhere Nebenwirkungsraten [Cappell und Kochenderfer 2021]. Ein Grund dafür könnte die schnellere Aktivierung von Effektor-T-Zellen sein. In Abbildung 7 sind die Inzidenzen eines schwerwiegenden CRS und/oder einer Neurotoxizität aus den Zulassungsstudien für die Behandlung des r/r DLBCL mit CAR- T-Zellen nach zwei vorangegangenen Therapien zusammengefasst. Ein direkter Vergleich dieser Studiendaten ist nicht möglich, da sich dafür die Patient:innen und ihre Behandlungspfade substanziell unterscheiden [Westin et al. 2021].
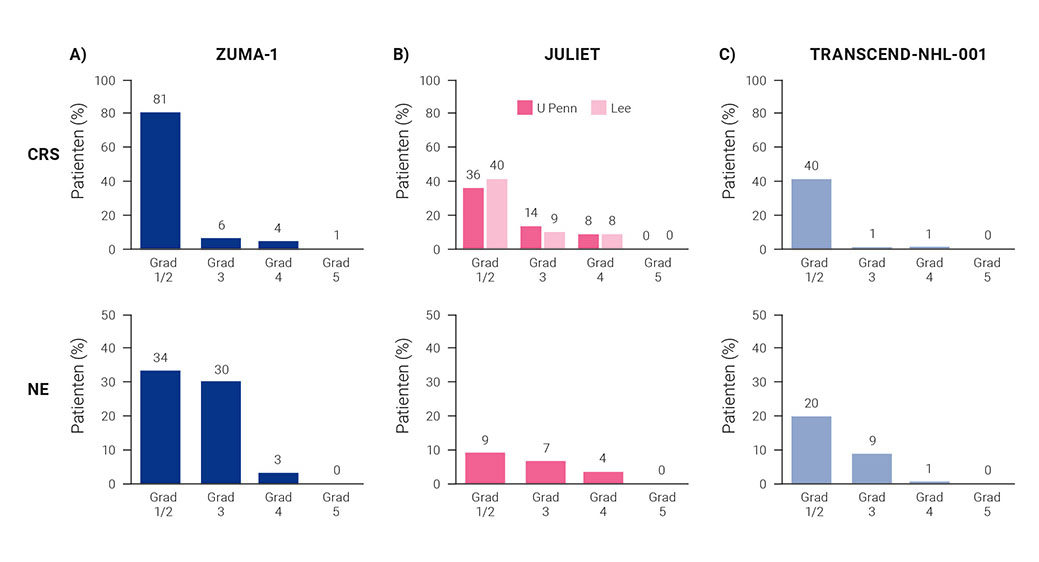
CAR: chimärer Antigenrezeptor; CRS: Zytokin-Freisetzungssyndrom (Cytokine Release Syndrome); DLBCL: diffus großzelliges B-Zell-Lymphom (Diffuse Large B-Cell Lymphoma); ICANS: Immu neffektorzell-assoziiertes Neurotoxizitätssyndrom (Immune Effector Cell-Associated Neurotoxicity Syndrome)
5.5 ERKENNTNISSE AUS DEM ALLTÄGLICHEN KLINISCHEN EINSATZ VON CAR-T-ZELLEN
Während Liso-Cel erst vor kurzem zugelassen wurde und daher noch wenig Daten aus dem Klinikalltag existieren, liegen für Axi-Cel und Tisa-Cel die ersten umfangreicheren Analysen für die Behandlung des r/r DLBCL nach zwei oder mehr Therapien vor. Diese bestätigen die in den Zulassungsstudien gezeigte Wirksamkeit der CAR-T-Zelltherapie: Die Gesamtansprechraten liegen im Rahmen der klinischen Regelversorgung bei ca. 70 %, die CR-Raten bei durchschnittlich ca. 50 % [Meng et al. 2021]. Abbildung 8 listet dazu die Ergebnisse einer Meta-Analyse aus 26 relevanten Studien zur DLBCL-Behandlung mit CAR-T-Zellen auf.
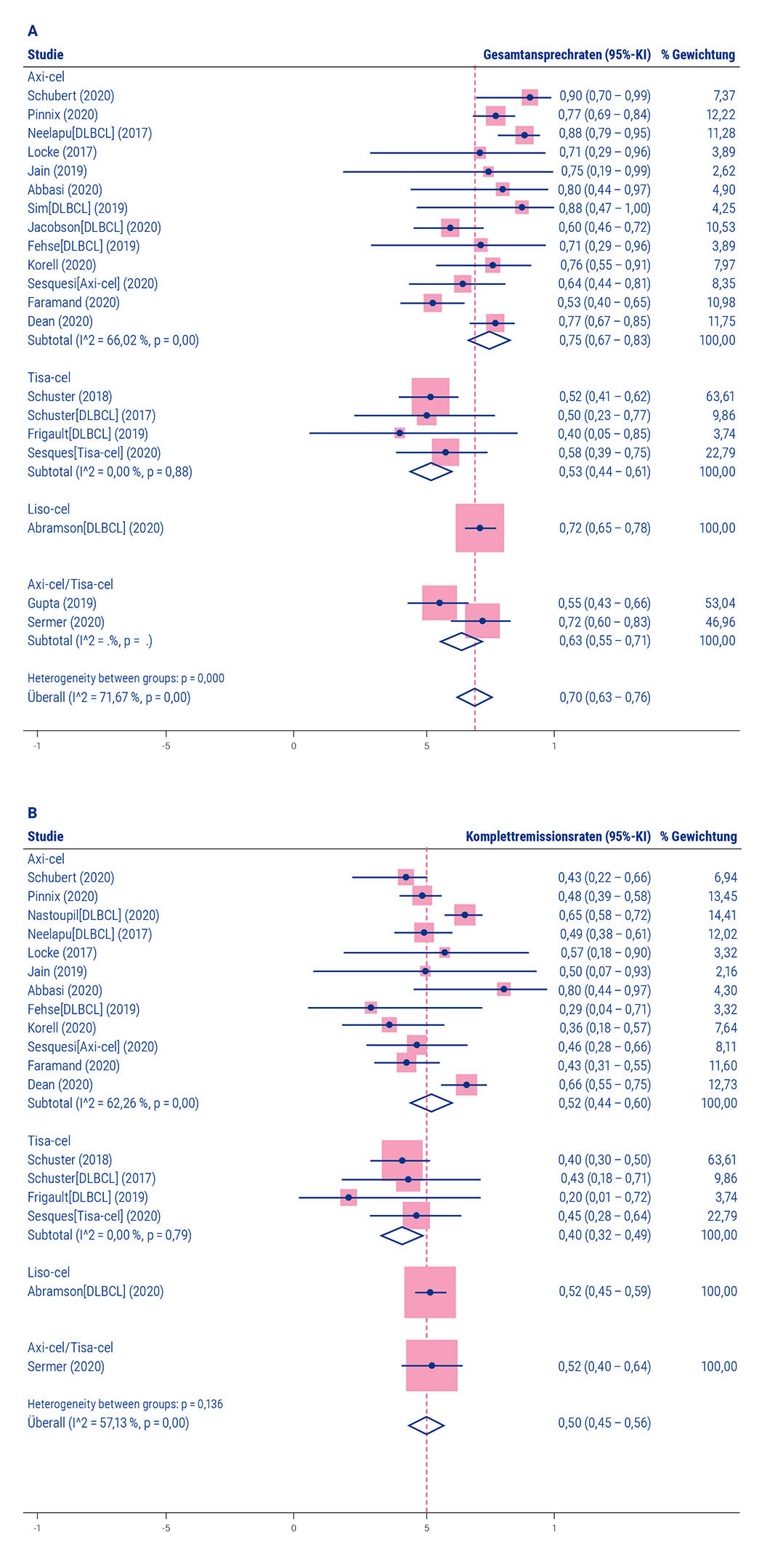
CAR: chimärer Antigenrezeptor; CRS: Zytokin-Freisetzungssyndrom (Cytokine Release Syndrome); DLBCL: diffus großzelliges B-Zell-Lymphom (Diffuse Large B-Cell Lymphoma); KI: Konfidenzintervall