CHIMÄRE-ANTIGENREZEPTOR-(CAR-)T-ZELLEN ZUR BEHANDLUNG DES REFRAKTÄREN ODER REZIDIVIERTEN DIFFUSEN GROẞZELLIGEN B-ZELL-LYMPHOMS
4 DIE ZELLTHERAPIE MIT CAR-T-ZELLEN
4.1 DAS THERAPIEPRINZIP
Die adoptive T-Zelltherapie verfolgt das Ziel, zytotoxische T-Zellen antigenspezifisch gegen Tumorzellen zu richten. Prof. Zelig Eshhar (Weizmann-Institut für Wissenschaften, Rehovot, Israel) stellte dazu Ende der 1980er-Jahre das konzeptuelle Design vor, die Bindedomäne eines Antikörpers mit einer Signaldomäne des T-Zell-Rezeptors (TCR) zu einem synthetischen Transmembranrezeptor zu verbinden [Eshhar et al. 1993]. Dieser erste Prototyp wies die wesentlichen Merkmale eines CAR der ersten Generation auf: ein Antikörperfragment (Single-Chain Variable Fragment, scFv) als antigenbindende Domäne, die Transmembrandomäne zur Verankerung in der Zellmembran sowie die CD3ζ-Signaldomäne des TCR im intrazellulären Teil zur T-Zell-Aktivierung (Abbildung 2).
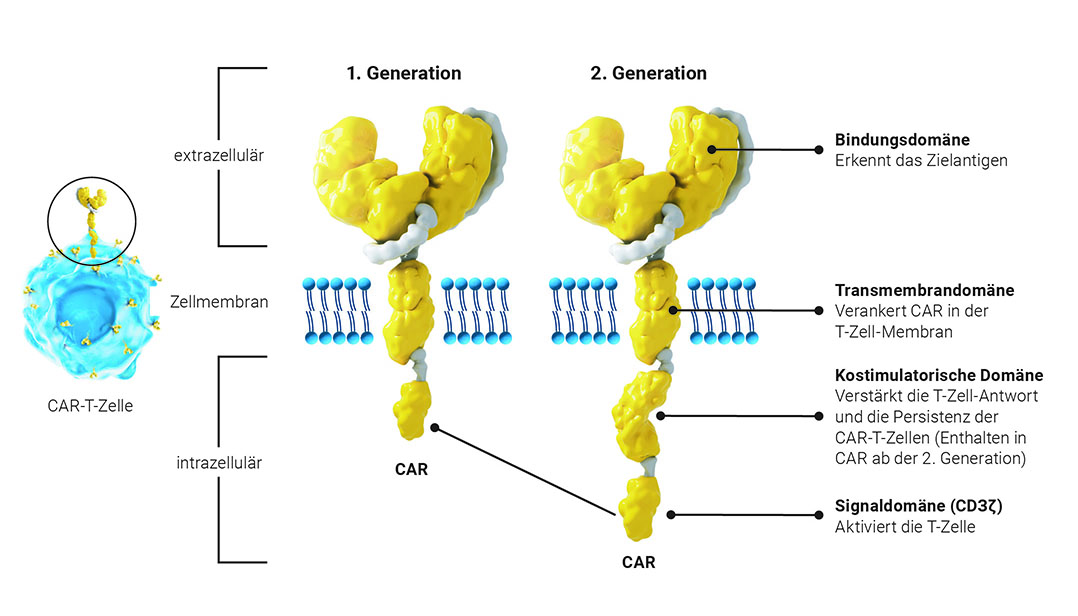
CAR: chimärer Antigenrezeptor
Durch die Bindung des CAR an das auf den Tumorzellen exprimierte Zielantigen (z. B. CD19) werden die CAR-T-Zellen (spezifisch) aktiviert und setzen zytolytische Granula, Chemokine sowie proinflammatorische Botenstoffe (z. B. Interferon-[IFN-]γ und Interleukin[IL-]2) frei. Gleichzeitig werden die CAR-T-Zellen auch zur Zellteilung angeregt. Das Resultat dieser Sequenz von Erkennung und Aktivierung ist die Zerstörung der (Ziel-)Tumorzelle u. a. über aktiviertes Granzym B, Perforin oder TRAIL-induzierte Apoptose [Trapani und Smyth 2002]. Darüber hinaus locken und aktivieren die freigesetzten Chemokine und Botenstoffe weitere Zellen der adaptiven (z. B. konventionelle T-Zellen) und angeborenen (z. B. Makrophagen) Immunität an, die sich im Sinne eines Bystander Killing an der antineoplastischen Immunantwort beteiligen (Abbildung 3).
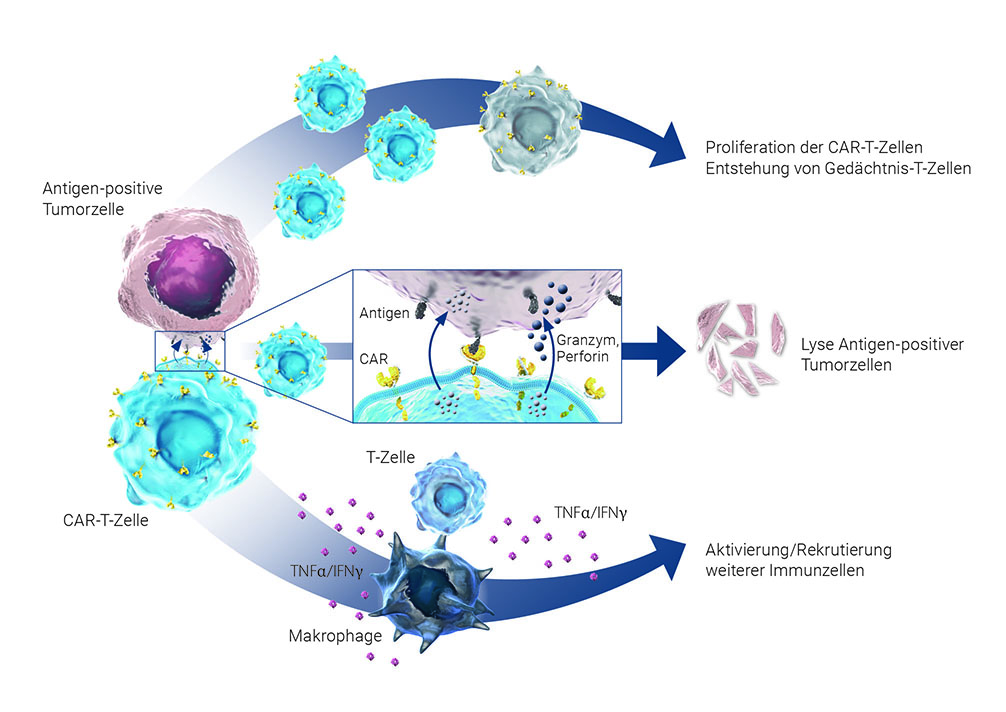
CAR: chimärer Antigenrezeptor
Während die CAR der ersten Generation nur das primäre Signal der T-Zell-Aktivierung lieferten, sind in den CAR ab der zweiten Generation zusätzlich intrazelluläre kostimulatorische Signaldomänen wie z. B. CD28 oder 41BB enthalten (Abbildung 2) [Finney et al. 2004]. Im Vergleich zu den CAR der ersten Generation, die nur ein begrenztes Aktivierungspotenzial haben, vermitteln die CAR der zweiten Generation durch die Kombination von Signaldomäne und kostimulatorischer Domäne eine stärkere T-Zell-Aktivierung mit gesteigerter konsekutiver Expansion, Persistenz und dadurch eine verbesserte Antitumorantwort. Die unterschiedlichen kostimulatorischen Domänen nehmen Einfluss auf die Stärke der Aktivierung und die Kinetik der CAR-T-Zell- Expansion und -Persistenz. So fördert die 4-1BB-vermittelte Kostimulation die Bildung von langlebigen Gedächtnis-T-Zellen, während CD28 über den PI3K/ AKT-Signalweg Sofortantworten von Effektor-T-Zellen induziert. So konvertieren nach wiederholter Stimulation mit dem Tumorantigen CD28-CAR-T-Zellen zu CD45RO+ CCR7-Effektor-Gedächtnis-T-Zellen und 41BB- CAR-T-Zellen zu CD45RO+CCR7+-Gedächtnis-T-Zellen [Holzinger und Abken 2021].
4.2 DURCHFÜHRUNG EINER CAR-T-ZELLTHERAPIE
CAR-T-Zellen werden für jede:n Patient:in individuell in einem aufwendigen Prozess hergestellt. Als Erstes werden dem:der Patient:in mittels Leukapherese Lymphozyten entnommen. Diese werden dann ex vivo stimuliert, expandiert und anschließend mit einem retro- oder lentiviralen Vektor so transduziert, dass sie den CAR exprimieren. Die Expansion wird im weiteren Verlauf fortgesetzt, um eine ausreichende Zellzahl für die Behandlung zu erhalten. Der Herstellungsprozess wird zunehmend in automatisierten, geschlossenen Systemen durchgeführt und kann bis zu mehrere Wochen dauern. Die Wahl der Ausgangspopulation der T-Zellen (z. B. mittels Separierung von CD4- oder CD8-positiven Zellen) sowie die Zellkultur-Bedingungen (z. B. die Art des Kulturmediums und der Zytokine) können sich auf Phänotyp und Antitumoraktivität der CAR-T-Zellen auswirken [Arcangeli et al. 2020, Sommermeyer et al. 2016]. Die Eigenschaften des CAR-T- Zell-Produktes als Determinante für klinische Wirksamkeit sind Gegenstand aktueller Forschung.
Im Rahmen einer CAR-T-Zelltherapie muss für jede:n Patient:in ein individueller Behandlungsplan mit den einzelnen Behandlungs- und Produktionsphasen umgesetzt werden. Dieser zeitaufwendige und mehrstufige Prozess ist in Abbildung 4 schematisch dargestellt.
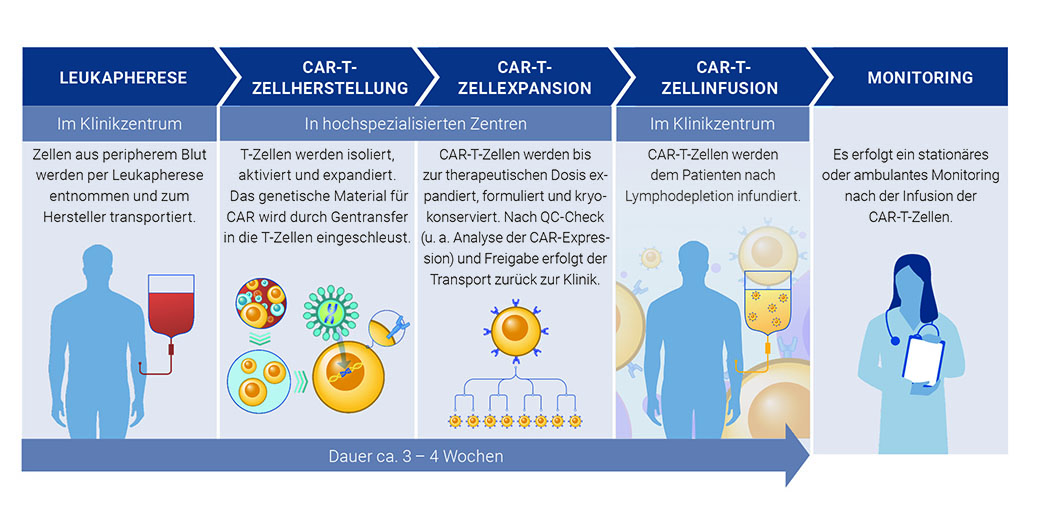
CAR: chimärer Antigenrezeptor; QC: Qualitätskontrolle (Quality Control)
Obwohl es sich bei den CAR-T-Zellen um ein modernes Immuntherapeutikum handelt, sind in der Therapiesequenz weiterhin Chemotherapeutika implementiert, wie im Folgenden genauer beschrieben.
4.2.1 Überbrückende Chemotherapie (Bridging-Therapie)
Da die Herstellung der CAR-T-Zellen einige Wochen dauern kann, muss in der Regel eine sog. Bridging- Therapie (z. B. mit Dexamethason und Vincristin oder auch als Radiotherapie) zur Kontrolle bzw. Reduktion der Tumorlast des:der Patient:in bis zur CAR-T-Zellgabe eingeleitet werden [Amini et al. 2022, Sim et al. 2019]. Die Bridging-Therapie sollte dabei, wenn möglich, erst nach der Leukapherese stattfinden, um gespendete T-Zellen nicht zu beeinträchtigen.
4.2.2 Chemotherapie zur Lymphozytendepletion
An den Tagen vor der Gabe von CAR-T-Zellen sollte zudem eine Chemotherapie zur Lymphozytendepletion (meist mit Fludarabin und Cyclophosphamid) durchgeführt werden, um u. a. im Knochenmark ausreichend Platz für eine Expansion (im Sinne einer homöostatischen Proliferation) der infundierten CAR-T-Zellen zu schaffen.
4.3 NEBENWIRKUNGEN DER CAR-T-ZELLTHERAPIE
4.3.1 Risikofaktoren für schwere Nebenwirkungen
Im Rahmen einer CAR-T-Zelltherapie können schwere Nebenwirkungen auftreten [Brudno und Kochenderfer 2019]. Zu den therapieassoziierten Nebenwirkungen gehören v. a. das Zytokin-Freisetzungssyndrom (Cytokine Release Syndrome, CRS) sowie das Immuneffektorzell-assoziierte Neurotoxizitätssyndrom (Immune Effector Cell-Associated Neurotoxicity Syndrome, ICANS). Patient:innen- sowie behandlungsassoziierte Faktoren können Einfluss auf das Risiko für das Auftreten von Nebenwirkungen nehmen (Abbildung 5).
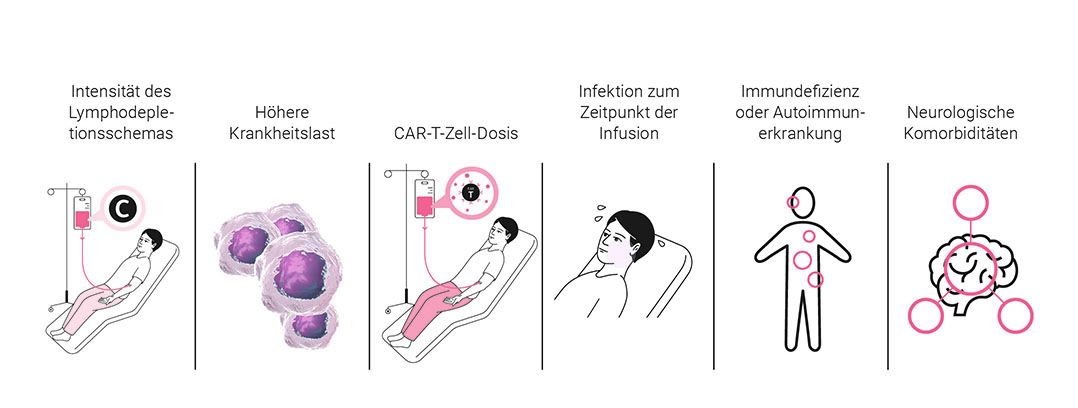
CAR: chimärer Antigenrezeptor
4.3.2 Zytokin-Freisetzungssyndrom
Das Zytokin-Freisetzungssyndrom (CRS) ist in den unterschiedlichen CAR-T-Zellstudien (für verschiedene Indikationen) bei 54 – 91 % der Patient:innen aufgetreten [Lee et al. 2019, Yan et al. 2021]. Das CRS ist eine systemische Entzündungsreaktion, ausgelöst durch eine massive Freisetzung pro-inflammatorischer Zytokine durch aktivierte CAR-T-Zellen. Die Symptome, welche sich im Median acht Tage nach Infusion der CAR-T-Zellen bemerkbar machen, ähneln oft einem akuten infektiösen Geschehen im Sinne grippaler Beschwerden bis hin zum Vollbild einer Sepsis. Im Vordergrund stehen Fieber, Blutdruckabfall und Sauerstoffunterversorgung. Zudem können spezifische Organtoxizitäten und ein Vascular-Leak-Syndrom auftreten. In einigen Fällen können intensivmedizinische Maßnahmen wie Kreislaufunterstützung durch Katecholamine, Dialyse oder invasive Beatmung indiziert sein.
Pathophysiologisch kommt dabei IL-6 eine Schlüsselrolle zu [Neelapu et al. 2018]. Zur Unterbrechung der Entzündungskaskade kann in der Klinik ein monoklonaler Antikörper gegen den IL-6-Rezeptor (z. B. Tocilizumab) eingesetzt werden. Das CRS war, vor dem routinemäßigen und frühzeitigen Einsatz von Tocilizumab, die häufigste schwerwiegende Nebenwirkung. Mit zunehmender Erfahrung mit dieser Therapieform sowie der Einführung und kontinuierlichen Weiterentwicklung standardisierter Handlungsanweisungen ist es heute gut handzuhaben. Schwerwiegende CRS-Verläufe (≥ Grad 3) können somit in den meisten Fällen abgewendet werden [Brücklein et al. 2020, Dholaria et al. 2019, Lee et al. 2019].
4.3.3 Neurotoxizität (ICANS)
Das ICANS entsteht vermutlich durch Entzündungsprozesse im Gehirn, die durch freigesetzte Zytokine von CAR-T-Zellen verursacht werden. Diese können zur Aktivierung der Mikroglia und zu endothelialen Dysfunktionen beitragen. Neurologische Störungen treten bei ca. 30 – 65 % der Patient:innen auf und sind in 90 % der Fälle mit einem CRS assoziiert. Das klinische Bild ist sehr variabel und reicht von leichter Desorientiertheit bis hin zum Hirnödem und Koma. Typischerweise ist der Verlauf aber moderat und selbstlimitierend, nur 10 – 30 % der CAR-T-Zell-Empfänger:innen weisen schwerere Verläufe (≥ Grad 3) auf. Die Neurotoxizität tritt in der Regel 5 – 6 Tage nach Infusion der CAR-T-Zellen auf und kann protrahiert verlaufen (mit einer Dauer von 6 – 17 Tagen). Spätmanifestationen (i. d. R. unabhängig vom CRS) ein bis zwei Monate nach Therapie können ebenfalls auftreten [Brücklein et al. 2020]. Bei der Behandlung des ICANS stehen in den Fällen, die CRS-assoziiert sind, Tocilizumab und darüber hinaus Steroide im Vordergrund. Analog zum CRS führt ein standardisiertes Vorgehen zu regelhafter Krankheitskontrolle [Brücklein et al. 2020].
4.3.4 Hypogammaglobulinämie
Ein Off-Target-Effekt von CD19-spezifischen CAR-T- Zellen ist die Depletion der gesunden CD19-positiven B-Zellen. Das kann zu einem prolongierten Antikörpermangel mit einer erhöhten Infektneigung führen (bei 14 – 43 % der Patient:innen). Betroffene mit Immunglobulin-G-(IgG-)Spiegeln < 4 g/L und/oder rekurrenten Infekten erhalten eine monatliche IgG-Substitutionstherapie. Eine B-Zell-Aplasie nach Gabe von CAR-T-Zellen kann monate- bis jahrelang anhalten.
4.3.5 Zytopenien
Bereits in den verschiedenen Zulassungsstudien wurden protrahierte Zytopenien (> 3 Monate nach CAR-T- Zellinfusion) einer oder mehrerer Zellreihen beschrieben [Abramson et al. 2020, Neelapu et al. 2017, Schuster et al. 2019]. Zytopenien im ersten Therapiemonat können auf die Lymphozytendepletion zurückgeführt werden. Für die darüber hinausgehenden Zytopenien (bei 16 % der Patient:innen nach Monat 3) ist der Mechanismus noch nicht abschließend geklärt [Cordeiro et al. 2020]. Die hämatopoietische Reserve und Inflammation scheinen jedoch wichtige Determinanten zu sein [Rejeski et al. 2021]. Eine kausale Therapie ist (noch) nicht etabliert. Je nach betroffener Zellreihe kann der Einsatz von G-CSF oder Thrombopoietin-Rezeptoragonisten erwogen werden. Sollten autologe Stammzellen verfügbar sein, kann auch ein Stammzell-Boost eine Option darstellen. Darüber hinaus sollte bei Bedarf eine antibakterielle, antivirale und antimykotische Prophylaxe verabreicht werden.